
Organoïdes cérébraux et réponse au stress dans les troubles du neurodéveloppement
Le grand nombre et l’hétérogénéité des troubles du neurodéveloppement (TND) sont un frein majeur au développement de thérapies. Récemment, des traits communs ont été identifiés tels que des signatures épigénétiques et de réponse au stress cellulaire aberrantes. Des travaux publiés dans la revue Nature Communications montrent que l’activité anormale de la voie de stress HSF n’est pas limitée aux TDN dues à un stress prénatal, mais s’étend aussi à des TND d’origine génétique, ouvrant la possibilité d’en faire une cible de futures stratégies thérapeutiques.
Les troubles du neurodéveloppement (TND) sont nombreux et variés
Le développement embryonnaire est un moment de grande vulnérabilité en raison des complexes réarrangements cellulaires et moléculaires qui s’y produisent. Le cerveau, qui se développe de la vie fœtale à l’adolescence, est particulièrement susceptible aux stress développementaux. Les troubles du neurodéveloppement (TND) sont donc nombreux et variés : il existe entre 200 et 300 TND et environ 10% des enfants sont affectés. L’origine des TND est soit génétique, soit environnementale, c’est-à-dire liée à des agressions prénatales telles que l’exposition à des toxiques (dont l’alcool), à des infections (virales ou bactériennes) ou au stress chez la mère. Alors que les TND sont une cause majeure de handicap à vie qui engendre un fort coût humain, sociétal et économique, la recherche sur les TND fait face à plusieurs défis qui entravent l’identification de mécanismes moléculaires fondamentaux et le développement de stratégies thérapeutiques : la grande diversité des TND, la variabilité des tableaux cliniques pour une même TND (voire causée par un même gène), la complexité des mécanismes qui contrôlent le neurodéveloppement, et l’impossibilité d’avoir un accès expérimental au cerveau en développement. Le domaine est donc en quête d’un changement de cadre conceptuel qui permettrait d’asseoir la découverte de mécanismes moléculaires d’intérêt pour le développement de nouveaux traitements.
Redéfinir le cadre conceptuel des études sur les TND
Des travaux antérieurs ont contribué à redéfinir le cadre conceptuel des études sur les TND en montrant qu’en dépit de leur hétérogénéité, les TND partagent un socle commun de mécanismes pathologiques : d’une part, des perturbations du paysage épigénétique (qui dicte l’accessibilité à la chromatine qui contient l’information génétique) et, d’autre part, une dérégulation des voies de réponse au stress cellulaire. Notamment, la voie des facteurs de transcription de réponse au stress cellulaire HSF (Heat Shock Factor), connue pour induire l’expression des gènes du stress (les chaperons moléculaires, HSP) lors de l’exposition à des toxiques est aussi impliquée dans le développement du cerveau. Cette voie opère par la régulation d’un répertoire de gènes contrôlant des étapes clés du neurodéveloppement. Son activation anormale, par exemple lors l’exposition prénatale à l’alcool, perturbe entre-autres l’expression des gènes nécessaires au positionnement correct des jeunes neurones dans le cerveau en formation.
Cette étude sert de base à un projet à visée thérapeutique
Combinant des approches biophysiques, biochimiques, mais aussi de modélisation et de biologie cellulaire, les scientifiques ont mis en évidence une cascade moléculaire dérégulée dans une TND rare, le syndrome de Rubinstein-Taybi (RSTS) causé par une mutation des gènes CBP/ EP300. Ils montrent que les gènes CBP/EP300 codant pour des enzymes épigénétiques (des acétyl-transférases) connues pour introduire des groupements acétyle dans la chromatine, ciblent aussi les facteurs de transcription HSF. En conséquence, l’expression de la N-cadhérine, une protéine d’adhérence cruciale pour le neurodéveloppement, est fortement diminuée. Pour explorer l’importance de cette cascade CBP/EP300-HSF2-N-cadhérine, les scientifiques ont généré, à partir de cellules de patients RSTS reprogrammées, des organoïdes cérébraux humains qui miment les premières étapes du neurodéveloppement. Ils ont retrouvé les perturbations de la cascade CBP/EP300-HSF2-N-cadhérine, ainsi que des anomalies phénotypiques cohérentes avec des perturbations de l’adhérence cellulaire.
En modélisant ainsi une TND qui combine des perturbations épigénétiques et celles de la voie HSF observées dans des TND d’origines génétique ou environnementale diverses, cette étude sert actuellement de base à un projet à visée thérapeutique.
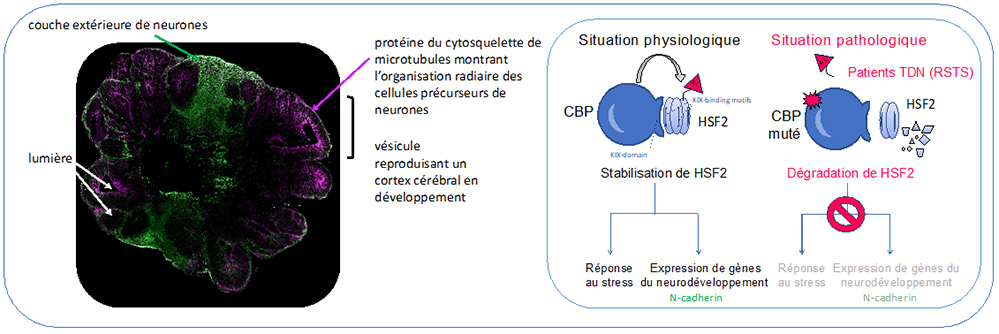
Figure : À gauche : coupe d’organoïde cérébral humain, « mini-cerveau » en culture 3D, montrant la présence de « vésicules » entourant des cavités (« lumières ») qui miment le développement précoce du cortex cérébral. Le profil d’expression de protéines du cytosquelette de microtubules (en rose) illustre l’organisation radiaire des cellules précurseurs des neurones, situés dans la partie interne des vésicules. On remarque la présence des premiers neurones, organisés en une couche située à l‘extérieur des vésicules (en vert). À droite : en situation physiologique, l’enzyme lysine-acétyl-transférase CBP modifie par un groupement acétyle le facteur de transcription HSF2 (« Ac ») promouvant ainsi l’expression des gènes de réponse au stress cellulaire qui contribuent à la survie des cellules et à l’expression d’un large répertoire de gènes clés pour le neurodéveloppement (ici, la N-cadhérine impliquée dans l’adhérence entre cellules). Dans le cas du syndrome RSTS, HSF2 n’est pas modifié, il est dégradé par la cellule et ne peut plus assurer son rôle dans ces processus.
Pour en savoir plus :
CBP-HSF2 structural and functional interplay in Rubinstein-Taybi neurodevelopmental disorder
Aurélie de Thonel, Ahlskog, Daupin, […] Lea Sistonen, Valérie Mezger
Nature Communications, 16 novembre 2022, DOI:10.1038/s41467-022-34476-2
En savoir plus sur les effets d’une exposition chronique à l’alcool sur la migration des jeunes neurones :
Heat shock factor 2 is a stress‐responsive mediator of neuronal migration defects in models of fetal alcohol syndrome
Rachid El Fatimy, Federico Miozzo, Anne Le Mouël, Ryma Abane, Leslie Schwendimann, Délara Sabéran-Djoneidi, Aurélie de ThonelIlliasse Massaoudi, Liliana Paslaru, Kazue Hashimoto-Torii, Elisabeth Christians, Pasko Rakic, Pierre Gressens, Valérie Mezger
EMBO molecular medecine, 15 juillet 2014 DOI:https://doi.org/10.15252/emmm.201303311
Source : www.insb.cnrs.fr




